Chemfort protegge dalla contaminazione batterica per 7 giorni
Il National Institute for Occupational Safety and Health (NIOSH) definisce un dispositivo di trasferimento di farmaci a sistema chiuso (CSTD) come “un dispositivo di trasferimento di farmaci che impedisce meccanicamente il trasferimento di contaminanti ambientali nel sistema e la fuoriuscita di concentrazioni pericolose di farmaci o vapori all’esterno del sistema”. (1)
I CSTD sono frequentemente utilizzati nella preparazione e somministrazione di farmaci oncologici. I pazienti oncologici sono spesso immunodepressi e quindi vulnerabili allo sviluppo di infezioni, che possono progredire rapidamente. Il rischio di infezione batterica in tali pazienti può includere polmonite ricorrente, bronchite, disfunzione, (2) e persino mortalità (60%). (3) Pertanto, è fondamentale che i farmaci preparati e somministrati a pazienti oncologici siano sterili e privi di batteri.
La FDA raccomanda la valutazione della capacità di un dispositivo medico di resistere o inibire il trasferimento di microrganismi infettivi in condizioni di utilizzo simulato ripetuto (4) in un test denominato ingresso microbico. La FDA ha fornito linee guida in merito alla pratica del test di ingresso microbico. Il test dovrebbe dimostrare che un dispositivo disinfettato non trasmetterebbe batteri, approvando un dispositivo per il periodo di utilizzo e il numero di cicli di connessione/disconnessione inclusi nella sua etichettatura. Il Chemfort® CSTD è stato testato alla luce delle linee guida della FDA e i risultati facevano parte dell’autorizzazione 510(k) pre-commercializzazione del sistema ai sensi del codice prodotto ONB (riservato ai sistemi chiusi di ricostituzione e trasferimento di farmaci antineoplastici e pericolosi).
Linee guida dello studio
L’obiettivo dello studio era confermare l’efficacia dei componenti del sistema chiuso Chemfort® nel prevenire il passaggio di batteri attraverso i dispositivi fino a 7 giorni e 10 cicli di connessione/disconnessione (attivazioni).
Metodo
Le quattro specie batteriche selezionate includono rappresentanti di entrambe le classi di specie batteriche (Gram-negative e positive). Altri criteri per la loro selezione sono stati l’elevata motilità e la frequente associazione con infezioni contratte in ospedale.(5)
Gli adattatori per fiale Chemfort® (VA) sono stati applicati su fiale di vetro sterili contenenti 100 mL di soluzione salina (Aminolab Ltd., Ness Ziona, Israele) e inoculati con uno dei quattro tipi di batteri. Siringhe monouso con connessioni Luer lock maschio sono state collegate agli adattatori per siringhe Chemfort® (SA) e gli SA sono stati collegati ai VA Chemfort® dopo che entrambi i setti sono stati disinfettati utilizzando un tampone di alcol isopropilico (IPA) al 70% o un tampone di IPA al 70%. Durante ogni attivazione, 3 mL di soluzione salina sono stati prelevati da ogni fiala e inseriti nella siringa collegata. Quindi gli SA sono stati scollegati dai VA ed entrambi sono stati immediatamente tappati fino all’attivazione successiva. Dopo la disconnessione tra VA e SA, SA è stato scollegato dalla siringa e la soluzione salina è stata fatta passare attraverso un filtro sterile con una membrana da 0,45 μm. La siringa è stata immediatamente ricollegata a SA e tappata. Le membrane sono state lavate con Tween allo 0,1% e poste su piastre Petri contenenti agar e incubate a 30-35ºC per 2-5 giorni. Per ogni dispositivo, questa procedura, iniziando con l’applicazione di microbi aggiuntivi ai setti, è stata ripetuta per un totale di 10 volte nel corso di 7 giorni (168 ore).
Per il gruppo di controllo positivo, è stata condotta la stessa procedura, escludendo la disinfezione. Per il gruppo di controllo negativo, sono state condotte le stesse procedure di disinfezione, attivazione e prelievo, ma senza inoculazione.
Per il gruppo di letalità batterica, i VA (non collegati alle fiale) sono stati inoculati con batteri di prova, trasferiti in una sacca sterile contenente 100 mL di soluzione salina con 0,1% di Tween 80 e agitati per 15 minuti, assicurando la massima agitazione. Parte dell’estratto è stata filtrata e incubata nello stesso modo dei gruppi di prova. Questa procedura è stata ripetuta 10 volte (con VA freschi ogni volta) in parallelo alle 10 attivazioni per gli altri gruppi di prova e di controllo.
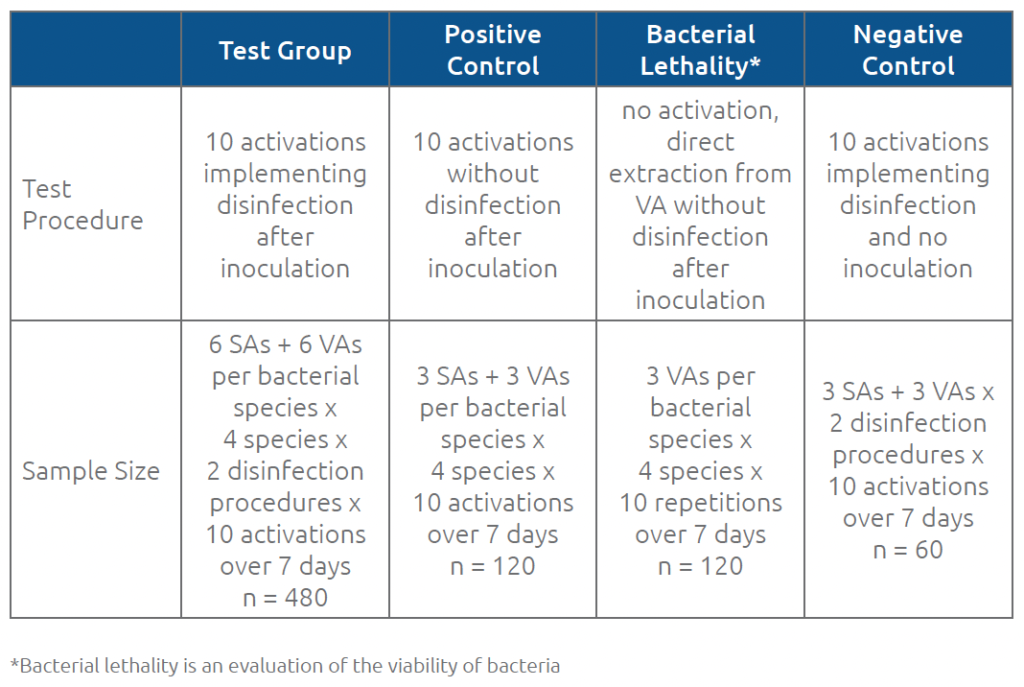
Per tutti i campioni di prova e di controllo, è stato contato e registrato il numero totale di colonie su ogni piastra. La Tabella 1 riassume le procedure e le dimensioni del campione per ogni gruppo.
Tabella 1. Procedure e dimensioni del campione per i gruppi di prova e di controllo
Risultati e discussione
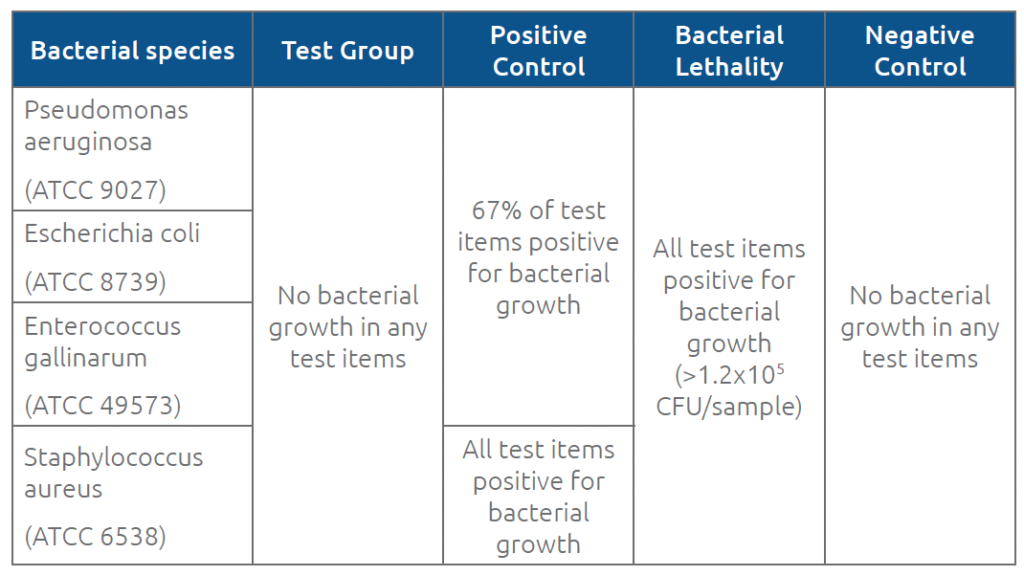
I criteri di accettazione sono stati definiti come <1 unità formante colonia (CFU)/campione (nessuna crescita microbica) per gli elementi di prova e i controlli negativi, >1 CFU/campione per gli elementi di controllo positivo (crescita microbica rilevabile) e >103 CFU/campione (crescita microbica estesa) per gli elementi di letalità batterica.
Non sono stati osservati segni di crescita microbica in nessuno degli elementi del gruppo di prova durante il periodo di prova di 7 giorni, incluse 10 attivazioni, quando si utilizzavano le procedure di disinfezione consigliate (tamponi IPA al 70% o tamponi IPA al 70%). Per il gruppo di controllo positivo, almeno un elemento testato con ciascuna delle 4 specie batteriche a ogni attivazione ha mostrato crescita microbica. Il fatto che alcuni campioni di controllo positivo (nessuna disinfezione) siano risultati negativi per la crescita indica che i setti Chemfort® a volte impediscono l’ingresso anche quando la disinfezione viene trascurata. Per ottenere un’indicazione più affidabile della vitalità batterica durante il test, è stato eseguito il test di letalità batterica, che non richiedeva che i batteri penetrassero nei setti Chemfort® per essere rilevati. Per i risultati del gruppo di letalità batterica, tutti gli articoli testati hanno mostrato più di 103 CFU per connettore di fiala. La Tabella 2 riassume i risultati per ciascun gruppo.
Tabella 2. Risultati per i gruppi di prova e di controllo
Il fatto che non sia stata osservata alcuna crescita in nessuno degli elementi del test durante il periodo di utilizzo di 7 giorni e il numero massimo di cicli di connessione/disconnessione dimostra la capacità di Chemfort® di mantenere l’integrità microbiologica anche in condizioni altamente difficili. Questi risultati sono in linea con altri studi che testano la capacità di Chemfort® di mantenere la sterilità anche oltre il periodo di utilizzo approvato dalle normative di 7 giorni(6) e la capacità del sistema di prevenire l’ingresso virale.(7) La prestazione di successo di Chemfort® nel test di ingresso microbico supporta la sua definizione di CSTD secondo NIOSH e ha favorito la sua autorizzazione FDA ai sensi del codice di prodotto ONB. Consente inoltre potenziali risparmi sui costi consentendo di utilizzare farmaci fisicamente e chimicamente stabili per almeno 7 giorni per 7 giorni interi (168 ore), quando altrimenti potrebbero essere scartati a causa di preoccupazioni di contaminazione microbica.(8)
Riferimenti
- NIOSH Alert: Prevenzione dell’esposizione professionale a farmaci antineoplastici e altri farmaci pericolosi in ambito sanitario 2004.
- Dipartimento della Salute e dei Servizi Umani degli Stati Uniti, Servizio di Sanità Pubblica, Centri per il Controllo e la Prevenzione delle Malattie, Istituto Nazionale per la Sicurezza e la Salute sul Lavoro, DHHS (NIOSH) Pubblicazione n. 2004–165.
- Safdar A, Bodey G, Armstrong D. (2011) Infezioni nei Pazienti con Cancro: Panoramica. Principi e Pratica delle Malattie Infettive del Cancro, 3–15. https://doi.org/10.1007/978-1-60761-644-3_1
- Bhat S, Muthunatarajan S, Mulki SS, Archana Bhat K, Kotian KH (2021). Infezione batterica tra i Pazienti con Cancro: Analisi degli Isolati e Modello di Sensibilità agli Antibiotici. Rivista internazionale di microbiologia, 8883700. https://doi.org/10.1155/2021/8883700
- Guida per l’industria e il personale della FDA: Intravascular Administration Sets Premarket Notification Submissions [510(k)], Dipartimento della Salute e dei Servizi Umani degli Stati Uniti Food and Drug Administration, 2008, Rockville, MD. http://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm070850.pdf
- Pechersky L. (2019). Microbial Ingress Testing of Tevadaptor^2 Closed System Components: Syringe Adaptor and Vial Adaptor (Report n. 5611). Dati in archivio su Simplivia.
- Walker KE, Machníková R, Ozolina L, Wilkinson AS, Johnson AJ. (2022) Eur. J. Hosp. Pharm. Pubblicato online per la prima volta: doi: 10.1136/ ejhpharm-2021-003148
- Amichay T, Shimon O, Raveh E. (2021) Pharm. Pract. 19(4): 2576.
- Juhasz A, Batka G, Szucs A. (2016). Drugs and Therapy Perspectives 32(4):170-6.
Per maggiori informazioni: apri il documento PDF